1. Điện Phân Nước Là Gì
Điện phân nước là quá trình phân tách phân tử nước (H₂O) thành các nguyên tố cấu thành là khí hydro (H₂) và khí oxy (O₂) thông qua việc sử dụng dòng điện một chiều. Đây là một quá trình điện hóa học, nơi năng lượng điện được chuyển hóa thành năng lượng hóa học, phá vỡ các liên kết phân tử nước.
1.1 Lịch Sử Phát Triển
Năm 1800: Alessandro Volta phát minh ra pin điện, mở đường cho các nghiên cứu về điện phân.
Năm 1800: William Nicholson và Anthony Carlisle thực hiện thành công điện phân nước đầu tiên.
Thế kỷ 19 & 20: Nghiên cứu tiếp tục phát triển, tối ưu hóa quá trình điện phân và khám phá các ứng dụng tiềm năng.
Hiện tại: Điện phân nước trở thành một lĩnh vực nghiên cứu trọng tâm trong bối cảnh tìm kiếm các nguồn năng lượng sạch và bền vững.
1.2 Tầm Quan Trọng của Điện Phân Nước
Sản xuất Hydrogen (H₂) xanh: Nguồn nhiên liệu sạch, không phát thải carbon khi đốt cháy, đóng vai trò quan trọng trong quá trình chuyển đổi năng lượng.
Sản xuất Oxy (O₂): Ứng dụng trong y tế, công nghiệp và các hệ thống hỗ trợ sự sống.
Nghiên cứu khoa học: Mở ra cánh cửa tìm hiểu sâu hơn về các quá trình điện hóa học, vật liệu và năng lượng.
2. Lý Thuyết Chi Tiết Về Quá Trình Điện Phân Nước
2.1 Phản Ứng Hóa Học
Phản ứng tổng quát:
2H₂O(l) → 2H₂(g) + O₂(g)Phản ứng tại Catot (Điện cực âm):
Trong môi trường axit (H⁺):
2H⁺(aq) + 2e⁻ → H₂(g)Trong môi trường bazơ (OH⁻):
2H₂O(l) + 2e⁻ → H₂(g) + 2OH⁻(aq)
Phản ứng tại Anot (Điện cực dương):
Trong môi trường axit (H⁺):
2H₂O(l) → O₂(g) + 4H⁺(aq) + 4e⁻Trong môi trường bazơ (OH⁻):
4OH⁻(aq) → O₂(g) + 2H₂O(l) + 4e⁻
2.2 Cơ Chế Điện Phân:
Sự phân li của nước: Dưới tác dụng của điện trường, các phân tử nước phân li một phần thành ion H⁺ và OH⁻ (mặc dù nước tinh khiết phân li rất ít).
Di chuyển của ion: Các ion H⁺ di chuyển về catot, các ion OH⁻ di chuyển về anot.
Phản ứng khử tại catot: Các ion H⁺ nhận electron và tạo thành khí H₂.
Phản ứng oxy hóa tại anot: Các ion OH⁻ nhường electron và tạo thành khí O₂ và nước.
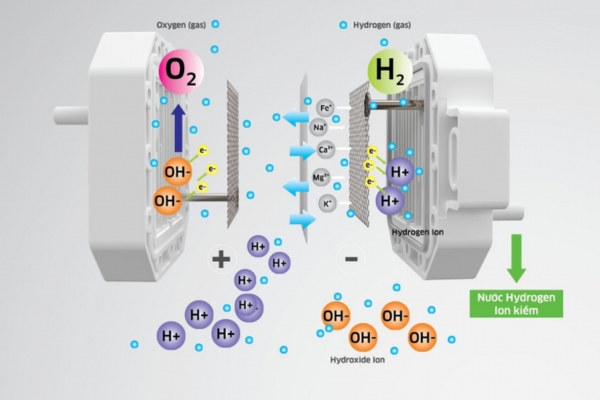
2.3 Các Yếu Tố Ảnh Hưởng Đến Hiệu Suất Điện Phân
Chất điện li:
Nước tinh khiết dẫn điện rất kém, cần thêm chất điện li để tăng độ dẫn điện.
Các chất điện li thường dùng: axit (H₂SO₄), bazơ (KOH, NaOH), muối (NaCl, Na₂SO₄).
Nồng độ chất điện li ảnh hưởng đến tốc độ và hiệu suất của phản ứng.
Điện cực:
Vật liệu điện cực: cần trơ với các chất phản ứng và có khả năng dẫn điện tốt (platinum, graphit, niken, inox…).
Hình dạng và bề mặt điện cực: diện tích bề mặt lớn giúp tăng tốc độ phản ứng.
Điện áp:
Cần điện áp đủ lớn để vượt qua thế phân cực của nước (khoảng 1.23V).
Điện áp quá cao có thể gây ra các phản ứng phụ và giảm hiệu suất.
Nhiệt độ:
Nhiệt độ tăng làm tăng tốc độ phản ứng, nhưng quá cao có thể làm bay hơi nước.
Khoảng cách điện cực:
Khoảng cách nhỏ giúp giảm điện trở, nhưng có thể gây đoản mạch.
3. Hướng Dẫn Thực Hành Điện Phân Nước Chi Tiết
3.1 Vật Liệu Chuẩn Bị
Nguồn điện: Bộ nguồn DC điều chỉnh được, pin 9V (nhưng hiệu suất thấp), bộ sạc điện thoại (cần điều chỉnh điện áp).
Điện cực:
Điện cực trơ: Thanh graphit (lấy từ lõi bút chì), dây platinum, inox.
Có thể dùng dây thép, nhưng sẽ có phản ứng phụ và bị ăn mòn.
Cốc đựng dung dịch: Cốc thủy tinh, bình nhựa chịu nhiệt.
Chất điện li: Muối ăn (NaCl), baking soda (NaHCO₃), axit sunfuric loãng (H₂SO₄),…
Dây dẫn điện: Dây cáp có kẹp cá sấu.
Ống nghiệm hoặc ống thu khí: Để thu khí hydro và oxy (tùy chọn).
Nước cất hoặc nước tinh khiết: Để đảm bảo độ tinh khiết của thí nghiệm.
Giấy quỳ tím: Để kiểm tra môi trường axit hoặc bazơ (tùy chọn).
Que diêm: Để kiểm tra khí oxy.
Bật lửa: Để kiểm tra khí hydro.
3.2 Các Bước Thực Hiện
Chuẩn bị dung dịch điện phân: Pha chất điện li vào nước cất cho đến khi tan hết.
Lắp đặt điện cực: Đặt hai điện cực vào cốc, đảm bảo chúng không chạm vào nhau và được ngập trong dung dịch.
Kết nối với nguồn điện: Nối các điện cực với nguồn điện bằng dây dẫn.
Điều chỉnh điện áp: Bật nguồn và điều chỉnh điện áp từ từ để quan sát phản ứng.
Quan sát quá trình điện phân: Quan sát sự tạo thành các bong bóng khí tại hai điện cực.
Thu khí (tùy chọn):
Úp ống nghiệm lên điện cực để thu khí.
Sau khi ống nghiệm đầy, dùng nút đậy kín.
Kiểm tra khí:
Oxy: Đưa que diêm còn tàn đỏ vào ống nghiệm chứa oxy, que diêm sẽ bùng cháy.
Hydro: Đưa ngọn lửa vào ống nghiệm chứa hydro, sẽ có tiếng nổ nhỏ (thí nghiệm này cần cẩn thận).
3.3 Lưu Ý Quan Trọng
An toàn:
Không chạm vào các điện cực đang có điện.
Thực hiện thí nghiệm ở nơi thoáng khí.
Không thu khí hydro trong không gian kín vì dễ gây nổ.
Đeo kính bảo hộ và găng tay khi thực hiện thí nghiệm.
Hiệu suất: Hiệu suất điện phân tại nhà thường thấp do nhiều yếu tố (điện cực, chất điện li,…).
Tỉ lệ khí: Thể tích khí hydro thu được gấp đôi thể tích khí oxy (tỉ lệ 2:1).
Môi trường: Tránh làm đổ dung dịch hóa chất ra ngoài.
=>>Xem thêm:
Polystyrene Có Độc Không? Lợi ích và Tác Hại Của Nhựa Polystyrene Bạn Cần Biết
Nhiệt Phân Là Gì? Tìm Hiểu Chi Tiết Quy Trình, Ứng Dụng Và Lợi Ích
4. Các Công Nghệ Điện Phân Nước Hiện Đại
4.1 Điện Phân Nước Kiềm (Alkaline Water Electrolysis – AWE)
Nguyên lý: Sử dụng dung dịch kiềm (KOH, NaOH) làm chất điện li.
Ưu điểm: Chi phí thấp, công nghệ đã được thương mại hóa.
Nhược điểm: Hiệu suất thấp hơn so với các công nghệ khác, cần các chất liệu chịu ăn mòn.
4.2 Điện Phân Nước Màng Trao Đổi Proton (Proton Exchange Membrane Electrolysis – PEM)
Nguyên lý: Sử dụng màng polymer trao đổi proton làm chất điện li, hoạt động trong môi trường axit.
Ưu điểm: Hiệu suất cao, mật độ dòng điện lớn, có thể hoạt động ở áp suất cao.
Nhược điểm: Chi phí cao, cần vật liệu điện cực và màng có độ bền hóa học cao.
4.3 Điện Phân Nước Anion (Anion Exchange Membrane Electrolysis – AEM)
Nguyên lý: Sử dụng màng polymer trao đổi anion, hoạt động trong môi trường kiềm.
Ưu điểm: Kết hợp ưu điểm của AWE và PEM, chi phí thấp hơn PEM.
Nhược điểm: Công nghệ đang trong quá trình phát triển.
4.4 Điện Phân Nước Ở Nhiệt Độ Cao (Solid Oxide Electrolysis Cell – SOEC)
Nguyên lý: Điện phân nước ở nhiệt độ cao (700-1000°C) sử dụng chất điện li rắn.
Ưu điểm: Hiệu suất rất cao, có thể sử dụng nhiệt thải.
Nhược điểm: Chi phí đầu tư cao, công nghệ phức tạp.
5. Ứng Dụng Đa Dạng Của Điện Phân Nước
5.1 Sản Xuất Hydro
Năng lượng: Pin nhiên liệu, xe chạy bằng hydro, lưu trữ năng lượng tái tạo.
Công nghiệp: Sản xuất amoniac, methanol, hóa chất.
Giao thông: Thay thế nhiên liệu hóa thạch trong vận tải.

5.2 Sản Xuất Oxy
Y tế: Hỗ trợ hô hấp, gây mê, điều trị bệnh.
Công nghiệp: Luyện kim, hàn cắt, sản xuất giấy.
Hệ thống hỗ trợ sự sống: Tàu vũ trụ, tàu ngầm, các môi trường thiếu oxy.

5.3 Các Ứng Dụng Khác
Tổng hợp hóa học: Điện phân để tạo ra các hợp chất hữu cơ và vô cơ.
Xử lý nước: Loại bỏ các chất ô nhiễm trong nước.
Nghiên cứu khoa học: Nền tảng cho các nghiên cứu về điện hóa học và năng lượng.
6. Tương Lai Của Điện Phân Nước
Hydrogen xanh: Đóng vai trò quan trọng trong quá trình chuyển đổi năng lượng, giảm phát thải carbon.
Cải tiến công nghệ: Nghiên cứu các vật liệu mới, chất xúc tác hiệu quả hơn, giảm chi phí và tăng hiệu suất.
Ứng dụng rộng rãi: Từ giao thông, công nghiệp đến sinh hoạt hàng ngày.
Kết hợp với năng lượng tái tạo: Tạo ra một hệ thống năng lượng bền vững và thân thiện với môi trường.
Quý khách hàng vui lòng liên hệ với Công ty Hóa chất Thịnh Phúc để được tư vấn và báo giá chi tiết:
• Hotline: 0833 299 222
• Email: [email protected]
• Website: www.hoachatthinhphuc.vn
Công ty Hóa chất Thịnh Phúc – Nâng tầm giá trị cho sản phẩm của bạn!
