Axit clohydric (HCl) không chỉ đơn thuần là một hợp chất hóa học, mà nó còn là một trong những axit mạnh mẽ nhất trong thế giới hóa học. Từ ứng dụng trong sản xuất hóa chất cho đến vai trò không thể thiếu trong hệ tiêu hóa, HCl hiện diện ở khắp mọi nơi, mang lại cả lợi ích lẫn nguy cơ cho người sử dụng. Bạn có từng nghĩ rằng một chất có thể ăn mòn kim loại lại có mặt trong dạ dày của chúng ta? Hãy cùng khám phá thế giới của axit clohydric từ những tính chất vật lý, hóa học cho đến ứng dụng thực tiễn và quy trình bảo quản an toàn nhé.
Tính chất vật lý và hóa học của axit clohydric
Axit clohydric là một hợp chất vô cơ có cấu trúc đặc biệt và có những tính chất vật lý và hóa học nổi bật. Đặc biệt, nó không chỉ tồn tại ở dạng lỏng mà còn dưới dạng khí. Bên cạnh đó, HCl khi hòa tan trong nước sẽ tạo thành một dung dịch có tính axit mạnh. Điều này không chỉ có ý nghĩa trong thực tiễn mà còn mang các giá trị về mặt khoa học hóa học.
Tính chất vật lý của HCl
Axit clohydric có nhiều tính chất vật lý độc đáo. Khi ở dạng khí, HCl không màu và có mùi xốc đặc trưng, chính vì vậy, việc nhận diện nó khi có mặt trong không khí trở nên dễ dàng. Dưới đây là một số tính chất vật lý đáng chú ý:
- Độ hòa tan: HCl hòa tan rất tốt trong nước với độ hòa tan lên đến 725g/l ở 20°C.
- Màu sắc: Dung dịch HCl trong nước không màu, nhưng với nồng độ cao, khoảng 40%, nó có thể xuất hiện với màu vàng nhạt.
- Khả năng bay hơi: Dung dịch HCl có khả năng dễ bay hơi và trong điều kiện ẩm, dễ dàng bốc khói trong không khí.

Thông qua những tính chất độc đáo này, chúng ta có thể thấy rõ tính chất mạnh mẽ của axit clohydric, từ đó giúp hiểu rõ hơn về vai trò của nó trong nhiều lĩnh vực.
Tính chất hóa học của HCl
HCl là một axit mạnh với rất nhiều tính chất hóa học quan trọng. Khả năng phân ly hoàn toàn trong dung dịch để giải phóng ion H⁺ và Cl⁻ là một trong những đặc điểm nổi bật. HCl có khả năng phản ứng với nhiều loại hợp chất khác nhau, như kim loại, oxit kim loại và bazơ. Dưới đây là một số phản ứng hóa học quan trọng của HCl:
- Phản ứng với kim loại: HCl phản ứng với các kim loại đứng trước hydro trong dãy hoạt động hóa học. Ví dụ, phản ứng với sắt:Fe + 2HCl → FeCl2 + H2
- Phản ứng với bazơ: HCl phản ứng với các bazơ mạnh như natri hydroxide (NaOH) để tạo ra muối clorua và nước:NaOH + HCl → NaCl + H2O
- Phản ứng với oxit kim loại: Ví dụ, phản ứng giữa HCl và đồng (II) oxit:CuO + 2HCl → CuCl2 + H2O
Những phản ứng này cho thấy HCl không chỉ đơn thuần là một axit mạnh, mà còn là một tác nhân hóa học quan trọng trong nhiều quá trình hóa học khác nhau.
Phương pháp điều chế axit clohydric
Axit clohydric có thể được điều chế bằng nhiều phương pháp khác nhau, giúp cho việc sản xuất axit này trở nên thuận tiện và đa dạng trong ngành công nghiệp hóa chất.
Phương pháp tổng hợp từ khí H2 và Cl2
Một trong những phương pháp phổ biến nhất để sản xuất HCl là thông qua sự phản ứng của khí hydro (H₂) và khí clo (Cl₂). Phản ứng này diễn ra theo phương trình sau:
H2 + Cl2 → 2HCl
Quy trình sản xuất HCl thường bắt đầu bằng việc điện phân muối ăn (NaCl) trong nước để tạo ra sodium hydroxide (NaOH), khí hydrogen (H₂), khí chlorine (Cl₂). Sau đó, các khí này được dẫn vào một tháp phản ứng, nơi chúng kết hợp và tạo ra HCl.
- Các bước trong quy trình:
- Điện phân muối: Tạo ra NaOH, H₂ và Cl₂.
- Phản ứng tạo HCl: H₂ và Cl₂ phản ứng với nhau để tạo ra HCl.
- Hấp thụ: HCl khí được hấp thụ để tạo ra dung dịch HCl, có nồng độ tối đa khoảng 40%.
Quy trình này không chỉ hiệu quả mà còn có tính khả thi cao trong việc sản xuất axit với số lượng lớn.
Quy trình sản xuất axit clohydric trong công nghiệp
Ngoài phương pháp tổng hợp từ H₂ và Cl₂, axit clohydric còn có thể được sản xuất qua phương pháp sunfat. Trong phương pháp này, axit sulfuric (H₂SO₄) được đưa vào tương tác với natri clorua (NaCl) ở nhiệt độ cao để sinh ra HCl.
- Phương trình phản ứng: NaCl + H2SO4 → NaHSO4 + HCl
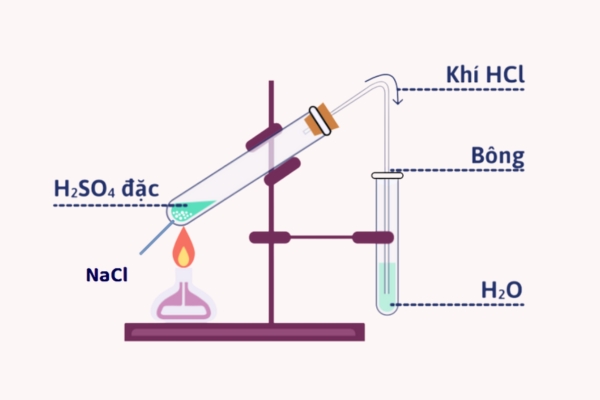
Phương pháp này cũng rất phổ biến trong ngành công nghiệp hóa chất và thường được ứng dụng rộng rãi.
Cả hai phương pháp đều cho thấy vai trò quan trọng của axit clohydric trong sự phát triển của ngành công nghiệp và công nghệ hiện đại.
Ứng dụng của axit clohydric trong đời sống
HCl không chỉ là một chất hóa học mạnh mà còn đóng vai trò quan trọng trong nhiều lĩnh vực khác nhau của đời sống, từ công nghiệp hóa chất cho đến ứng dụng trong các ngành khác như thực phẩm và y tế.
Ứng dụng trong công nghiệp sản xuất hóa chất
Axit clohydric được sử dụng rộng rãi trong ngành công nghiệp sản xuất hóa chất. HCl là thành phần chính trong nhiều phản ứng hóa học nhằm tổng hợp các sản phẩm hóa học khác. Một số ứng dụng của HCl trong lĩnh vực này bao gồm:
- Sản xuất clorua: HCl là nguyên liệu cần thiết để sản xuất nhiều loại clorua và hợp chất hóa học như PVC (polyvinyl clorua) hay axit sulfuric (H₂SO₄).
- Tổng hợp hợp chất hữu cơ và vô cơ: HCl có vai trò không thể thiếu trong việc tổng hợp nhiều hợp chất, cung cấp nguyên liệu cho các ngành chế biến hóa chất.
- Sản xuất thuốc trừ sâu: Nhiều thuốc trừ sâu và hóa chất bảo vệ thực vật cũng cần có HCl trong quy trình sản xuất.
Những ứng dụng này không chỉ giúp cải thiện hiệu suất sản xuất mà còn thúc đẩy nền kinh tế hóa chất phát triển.
Ứng dụng trong xử lý kim loại
HCl không chỉ có mặt trong sản xuất hóa chất mà còn có những ứng dụng quan trọng trong ngành xử lý kim loại. Các nhà máy thường sử dụng HCl để tẩy rỉ và làm sạch bề mặt kim loại trước khi thực hiện các bước chế tạo tiếp theo.
- Quy trình tẩy rỉ:
- Kim loại như sắt, thép được ngâm trong dung dịch HCl để làm sạch bề mặt.
- Đây là một bước quan trọng để cải thiện độ bám dính của sơn hoặc các loại phủ khác.
- Phản ứng tạo muối clorua: HCl cũng giúp tạo ra các muối clorua từ kim loại, là nguyên liệu cho nhiều quy trình chế biến khác.
Với tính mạnh của axit, HCl không chỉ làm sạch bề mặt mà còn giúp tạo ra những sản phẩm mới hữu ích cho nhiều ngành công nghiệp.
Ứng dụng trong điều chỉnh pH nước
Trong ngành xử lý nước, axit clohydric được sử dụng để điều chỉnh nồng độ pH của nước, điều này là cần thiết trong quá trình sản xuất nước sạch và xử lý nước thải.
- Điều chỉnh pH: HCl có thể được sử dụng để giảm độ pH của nước, giúp tạo ra môi trường nước ổn định cho các quy trình công nghiệp khác.
- Xử lý nước thải: Ngành công nghiệp chế biến thực phẩm và dược phẩm thường cần HCl để đảm bảo độ pH của nước đạt tiêu chuẩn an toàn trước khi được thải ra môi trường.

Do đó, HCl không chỉ là một axit mạnh mẽ mà còn góp phần quan trọng trong bảo vệ môi trường và sức khỏe cộng đồng.
An toàn và biện pháp bảo quản axit clohydric
Vì tính chất ăn mòn mạnh, axit clohydric chứa nhiều nguy cơ tiềm ẩn. Do đó, việc tuân thủ các biện pháp an toàn trong quá trình sử dụng và bảo quản là vô cùng quan trọng.
Biện pháp an toàn khi sử dụng HCl
Khi làm việc với HCl, việc bảo vệ bản thân khỏi các tác hại của axit là điều cần thiết. Dưới đây là những biện pháp an toàn bạn cần chú ý:
- Thiết bị bảo hộ cá nhân: Luôn đeo kính bảo hộ, găng tay cao su và mặt nạ phòng độc khi làm việc với HCl để giảm thiểu nguy cơ tiếp xúc.
- Khu vực thông gió: HCl nên được sử dụng trong khu vực có thông gió tốt hoặc trong tủ hút khí độc, nhằm tránh việc hít phải hơi axit.
- Pha loãng HCl: Khi pha loãng, hãy luôn cho HCl vào nước từ từ để tránh hiện tượng phun ra hoặc sôi.
Những biện pháp này sẽ giúp bạn bảo vệ bản thân và đảm bảo an toàn trong quá trình làm việc với hóa chất nguy hiểm này.
=>>Xem thêm: Acid Citric Là Gì? Ứng Dụng Của Acid Citric
=>>Xem thêm: Tìm Hiểu Về Axit Formic – Hợp Chất Axit Đơn Giản Nhất
Hướng dẫn lưu trữ axit clohydric đúng cách
Để bảo quản axit clohidric đúng cách, hãy tuân thủ các hướng dẫn sau:
- Vị trí lưu trữ: Lưu trữ HCl ở nơi khô ráo, thoáng mát, tránh ánh nắng trực tiếp và ẩm ướt.
- Thùng chứa thích hợp: HCl nên được lưu trữ trong các thùng chứa bằng vật liệu chịu axit, chẳng hạn như nhựa polyethylene, không được sử dụng kim loại.
- Kho chứa an toàn: Kho chứa cũng cần được làm từ vật liệu chịu axit và đặt xa khu vực dân cư và nguồn nước sinh hoạt.
Nếu tuân thủ các biện pháp này, bạn có thể đảm bảo an toàn cho bản thân, cũng như bảo vệ môi trường xung quanh.
Phản ứng của axit clohydric với các chất khác
Phản ứng hóa học của axit clohydric với các chất khác là một trong những điều thú vị của việc nghiên cứu hóa học. HCl có thể tương tác với nhiều loại hợp chất, từ kim loại đến muối.
Phản ứng của HCl với kim loại
HCl phản ứng với nhiều loại kim loại, đặc biệt là những kim loại đứng trước hydro trong dãy hoạt động hóa học:
- Phản ứng với kẽm (Zn): Khi kẽm tác dụng với HCl, sản phẩm thu được là kẽm clorua và khí hydro:Zn + 2HCl → ZnCl2 + H2
- Phản ứng với sắt (Fe): Tương tự, khi sắt kết hợp với HCl, sản phẩm tạo ra là clorua sắt II và khí hydro:Fe + 2HCl → FeCl2 + H2
- Kim loại không phản ứng: Một số kim loại như đồng (Cu) không phản ứng với HCl do nằm sau hydro trong dãy hoạt động hóa học.
Điều này cho thấy khả năng mạnh mẽ của HCl trong việc tương tác với các kim loại khác nhau, mở ra nhiều khả năng trong ứng dụng công nghiệp.
Phản ứng của HCl với bazơ
HCl cũng là một trong những axit quan trọng trong việc phản ứng với các bazơ. Khi HCl tác dụng với bazơ mạnh, nó sẽ tạo ra muối và nước. Dưới đây là một số phản ứng tiêu biểu:
- Phản ứng với natri hydroxide (NaOH):NaOH + HCl → NaCl + H2O
- Phản ứng với đồng II oxit (CuO):CuO + 2HCl → CuCl2 + H2O
Các phản ứng này không chỉ bộc lộ tính chất axit của HCl mà còn làm nổi bật sự tương tác tích cực giữa axit và bazơ.
Phản ứng của HCl với muối
Các muối cũng có khả năng phản ứng với HCl, nhưng thường chỉ xảy ra nếu muối đó có gốc anion yếu hơn HCl. Dưới đây là những ví dụ điển hình:
- Phản ứng với bicarbonat (NaHCO₃):NaHCO3 + HCl → NaCl + H2O + CO2
- Phản ứng với cacbonat (CaCO₃):
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Phản ứng này chứng tỏ rằng HCl không chỉ là axit mạnh mà còn có khả năng tạo ra sản phẩm mới trong một loạt các phản ứng hóa học.
So sánh nồng độ khác nhau của axit clohydric
Axit clohydric có thể tồn tại ở nhiều nồng độ khác nhau và mỗi loại nồng độ có những ứng dụng riêng, phù hợp với các nhu cầu khác nhau của ngành công nghiệp.
Sự khác biệt giữa HCl loãng và HCl đặc
- HCl loãng: Thường có nồng độ từ 10% đến 20% và được sử dụng chủ yếu trong vệ sinh, làm sạch bởi vì tính ăn mòn không quá mạnh trong mức độ này.
- HCl đặc: Nồng độ khoảng 32% đến 34% và thường được sử dụng cho các ứng dụng công nghiệp đòi hỏi sức mạnh axit cao hơn, như trong sản xuất muối hay chế biến hóa chất.
Dưới đây là bảng so sánh nói về sự khác biệt giữa HCl loãng và đặc:
| Thông tin | HCl Loãng | HCl Đặc |
|---|---|---|
| Nồng độ | 10% – 20% | 32% – 34% |
| Ứng dụng | Vệ sinh, làm sạch | Sản xuất hóa chất |
| Tính ăn mòn | Thấp hơn | Cao hơn |
Việc lựa chọn nồng độ phù hợp sẽ phụ thuộc vào yêu cầu cụ thể của ứng dụng mà bạn đang thực hiện.
Ứng dụng của các nồng độ khác nhau trong công nghiệp
Mỗi nồng độ của axit clohydric có ứng dụng riêng trong ngành công nghiệp. Dưới đây là một số tính năng nổi bật của từng nồng độ:
- HCl loãng: Thích hợp cho việc tẩy rửa các bề mặt kim loại, làm sạch oxit và tạo ra môi trường an toàn hơn cho người sử dụng.
- HCl đặc: Được sử dụng trong sản xuất muối NaCl, xử lý bề mặt thép, tạo thành sản phẩm hóa học hữu ích, chẳng hạn như FeCl₂ và ZnCl₂.
Như vậy, việc sử dụng HCl với nồng độ khác nhau phản ánh sự linh hoạt và khả năng ứng dụng trong các lĩnh vực công nghiệp hiện đại.
Kết luận
Trong tổng thể, axit clohydric, hay HCl, là một hóa chất mạnh mẽ và đóng vai trò quan trọng trong nhiều lĩnh vực. Từ sản xuất hóa chất tới điều chỉnh pH trong nước, HCl chứng tỏ giá trị của mình ở khắp nơi. Tuy nhiên, với sức mạnh đó cũng đi kèm là những rủi ro và nguy hiểm, đòi hỏi mỗi người cần phải tuân thủ các biện pháp an toàn nghiêm ngặt trong quá trình sử dụng và bảo quản. Chắc chắn rằng với hiểu biết sâu sắc về HCl, chúng ta có thể khai thác hiệu quả những lợi ích mà nó mang lại mà vẫn đảm bảo an toàn cho môi trường và con người.
Quý khách hàng vui lòng liên hệ với Công ty Hóa chất Thịnh Phúc để được tư vấn và báo giá chi tiết:
• Hotline: 0833 299 222
• Email: [email protected]
• Website: www.hoachatthinhphuc.vn
Công ty Hóa chất Thịnh Phúc – Nâng tầm giá trị cho sản phẩm của bạn!
